Forschungsthema
Das humane Hepatitis C Virus (HCV)
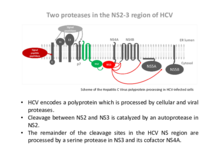
HCV ist auf der Ebene der Genomorganisation mit den Pestiviren näher verwandt als mit den Vertretern des Genus Flavirvirus. Weltweit leiden ca. 130 Mio. Menschen an einer chronischen HCV Infektion. Diese Infektionen sind eine der Hauptursachen für Leberzirrhose und hepatuzelluläres Karzinom. Aktuelle Therapiekonzepte führen nur bei einem Teil der chronisch Infizierten zur Eliminierung des HC Virus. Weiterhin sind diese Viren sehr variabel, wodurch langfristig eine Vielzahl verschiedener Targets/Wirkstoffe für die antivirale Therapie benötigt werden. Somit sind weitere Untersuchungen zur Identifizierung viraler Zielstrukturen für antivirale Substanzen sinnvoll. Das HCV Polyprotein umfasst zwei Proteasen, die für die virale Replikation von essentieller Bedeutung sind. Die beiden viralen Proteasen im Bereich des NS2-3 werden daher von unserer AG im Detail bezüglich ihrer Funktion und Regulation untersucht und auf molekularer Ebene mit den pestiviralen Enzymen verglichen.
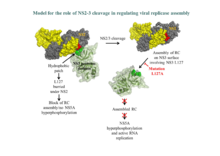
Wir konnten nachweisen, dass die Cysteinprotease im NS2 des HCV auch ohne NS3 eine Basalaktivität aufweist und somit selbst eine bona fide Protease darstellt. Diese Basalaktivität wird in Anwesenheit der im Polyprotein darauf folgenden N-terminalen Serinproteasedomäne des NS3 massiv gesteigert. Für die Aktivierung der NS2 Protease ist die Serinproteaseaktivität des NS3 nicht essentiell. Wir konnten zeigen, dass ein Teilbereich der NS3-Proteasedomäne deletiert werden kann, ohne dass die Aktivierung der NS2 Protease dadurch behindert wird und dass der C-terminale Teil des NS3 auch in trans effektiv zur Aktivierung der NS2 Protease beitragen kann.
Aktuelle Untersuchungen konzentrieren sich auf die Frage welche Bereiche des NS3 für die Aktivierung benötigt werden und wie diese Aktivierung auf molekularer Ebenen abläuft.
Forschungsgruppe
Gruppenleiter:
Dr. rer. nat. Olaf Isken

Technische Mitarbeiterinnen:
Barbara Bruhn
Julia Larsen