Molekulare Pathogenese der Mucosal Disease
N. Tautz*, H.-J. Thiel#
# Institut für Virologie, Fachbereich Veterinärmedizin, JLU Giessen
* Institut für Virologie und Zellbiologie, Universität zu Lübeck
Das Virus der bovinen Diarrhoe (BVDV-1, BVDV-2), das Virus der klassischen Schweinepest und das „border disease“ Virus der Schafe bilden das Genus Pestivirus in der Virusfamilie Flaviviridae. Zu derselben Familie gehören außerdem das Genus Flavivirus mit Vertretern wie Frühsommermeningeoencephalicitsvirus, Gelbfiebervirus und „louping ill“ Virus sowie das Genus Hepacivirus mit dem Hepatitis C Virus (22).
Pestiviren sind kleine (40-60 nm) behüllte Viren, deren Genom aus einer einzelsträngigen RNS positiver Polarität mit meist etwa 12.300 Nukleotiden besteht. Die Genomorganisation ist in Abb. 1 wiedergegeben. Die Abschnitte im 5’ und 3’ terminalen Bereich des Genoms kodieren nicht für Proteine (nicht translatierte Regionen, UTR), enthalten aber wichtige Signale für die Vermehrung des Virusgenoms und die Synthese der Virusproteine durch die Zelle.
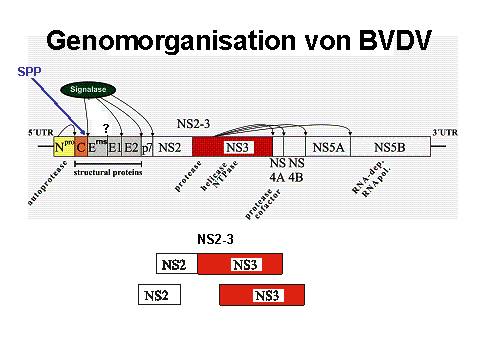
Nach Infektion einer Zielzelle wird ausgehend von der viralen RNS ein hypothetisches Polyprotein synthetisiert. Dieses Polyprotein, bestehend aus etwa 3.900 Aminosäuren, wird teilweise schon während der Translation durch zelluläre und virale Enzyme in die reifen Virusproteine gespalten. Das erste durch das virale Genom kodierte Protein ist die N-terminale Protease (Npro). Dieses Protein spaltet sich vom Rest des Polyproteins ab (Autoprotease). Es folgen die viralen Strukturproteine: das Kapsidprotein (C) sowie die Glykoproteine Erns (E für „envelope“, Hülle; rns für Ribonuklease sezerniert), E1 und E2. Das Kapsidprotein bildet mit der viralen Nukleinsäure das Core, den vermutlich ikosahedralen Innenkörper des Virus. Umgeben ist das Core von einer Lipidmembran, die das Virus im Verlauf der Partikelreifung von der Wirtszelle erhält. In diese Lipidmembran sind die viralen Glykoproteine eingebettet. Das Glykoprotein E2 induziert nach Infektion oder Impfung neutralisierende Antikörper. Neben E2 induziert auch das Glykoprotein Erns neutralisierende Antikörper nach Infektion eines Wirtes.
Dem für die Strukturproteine kodierenden Bereich folgt im viralen Genom ein Abschnitt, der für die folgenden Nichtstrukturproteine (NS) kodiert:
p7, NS2, NS3, NS4A, NS4B, NS5A und NS5B. Die NS-Proteine dienen dem Virus u.a. zur Spaltung dieses Teils vom Polyprotein (Proteasen NS2 und NS3) und zur Vervielfältigung seines Genoms (RNS-Polymerase NS5B). Von besonderem Interesse ist das NS3, weil es lediglich nach Infektion mit zytopathogenen Pestiviren über den gesamten Verlauf der Infektion in großen Mengen nachweisbar ist. Pestiviren kommen als zwei Biotypen vor, die im Hinblick auf ihre Eigenschaften bei der Vermehrung in Kulturzellen unterschieden werden. Nicht zytopathogene (nzp) Pestiviren replizieren ohne sichtbare Veränderungen der Zielzellen. Im Gegensatz dazu führt die Infektion mit zytopathogenen (zp) Pestiviren zur Lyse infizierter Zellen. Im Falle von zp BVDV ist neben dem Vorläuferprotein NS2-3 stets auch NS3 in erheblichen Mengen vorhanden. Bei einer Infektion mit nzp BVDV lässt sich NS3 hingegen nur über einen Zeitraum von wenigen Stunden nach Infektion nachweisen (12).
BVDV führt zu einer systemischen Infektion, die demnach mit Virämie einhergeht. Die Folgen einer solchen Infektion können vielfältig sein. Während Infektionen nicht tragender Tiere oft klinisch inapparent verlaufen, kann es bei trächtigen Tieren zur diaplazentaren Übertragung des Virus mit schwerwiegenden Folgen für den Embryo/Fötus kommen. Hierbei spielt das Trächtigkeitsstadium in Verbindung mit der Entwicklung des fötalen Immunsystems eine wichtige Rolle. Bei Infektionen ausschließlich mit nzp BVDV etwa zwischen dem 40. und 125. Trächtigkeitstag kann sich eine persistierende Infektion des Fötus etablieren. In dieser Zeitspanne ist das Immunsystems des Fötus noch nicht entwickelt, und es kommt daher zu einer erworbenen Immuntoleranz gegenüber dem betreffenden nzp BVDV-Stamm. Persistent infizierte Tiere scheiden Virus lebenslang in großen Mengen aus und stellen hierdurch ein besonders wichtiges Erregerreservoir dar. Solche Tiere sind meist negativ in Tests auf Antikörper gegen BVDV, können jedoch nach Infektion mit einem heterologen BVD-Virusstamm Antikörper bilden. Persistent infizierte Tiere bleiben häufig im Wachstum zurück (sog. Kümmerer), können aber klinisch unauffällig sein (23).
Eine persistierende Infektion mit einem nzp BVDV-Stamm ist Voraussetzung für die Entstehung der Mucosal Disease (MD) des Rindes. Diese tödlich verlaufende Infektionskrankheit tritt meist im Alter von sechs Monaten bis zwei Jahren auf. Das klinische Bild der MD ist durch Fieber, Anorexie und eine hochgradige, häufig blutige Diarrhoe gekennzeichnet; der Tod tritt meist innerhalb von zwei bis zehn Tagen nach Auftreten der Symptome ein. An den Schleimhäuten des gesamten Verdauungstraktes können Läsionen wie Ulzerationen und Nekrosen vorliegen. Im Bereich des Verdauungstraktes kommt es außerdem zu einer ausgeprägten Zerstörung des lymphatischen Gewebes. Ferner zählen Hautnekrosen im Zwischenklauenspalt zum Spektrum der klinischen Erscheinungen.
Wie bereits erwähnt, sind persistent infizierte Tiere immer Träger von BVD-Viren, die keinen zytopathischen Effekt in Kulturzellen induzieren (nzp BVD-Viren). Interessanterweise lässt sich aus an MD erkrankten Tieren neben nzp BVDV stets ein zp BVDV isolieren; zp BVDV und nzp BVDV aus einem Tier werden als Viruspaar bezeichnet. Vergleichende Analysen haben nämlich gezeigt, dass sich die aus einem Tier stammenden zp und nzp Virusisolate serologisch in der Regel nicht oder nur geringfügig voneinander unterscheiden. Dies ist bemerkenswert, da die antigenetische Variabilität von BVDV sehr ausgeprägt ist. Daher lag die Vermutung nahe, dass das zp BVD-Virus im persistent infizierten Tier durch Mutation aus dem nzp Virus hervorgeht. Diese Hypothese konnte in den letzten 15 Jahren u.a. durch molekulare Charakterisierung zahlreicher Viruspaare verifiziert werden (17). Im Rahmen dieser Studien wurden Veränderungen in Genomen von zp BVD Viren identifiziert, die bei nzp BVDV nicht vorkommen. Bemerkenswert ist die Tatsache, dass die meisten zp BVDV Stämme durch RNA Rekombination entstehen, auch wenn einigen zp BVDV Stämmen solche offensichtlichen Rearrangements der Genome fehlen. Die bei zp BVD Viren gefundenen Veränderungen korrelieren mit erhöhter NS3 Expression, erhöhter RNA Replikation und Zytopathogenität. Im folgenden werden zwei Gruppen der beschriebenen Genomveränderungen kurz dargestellt:
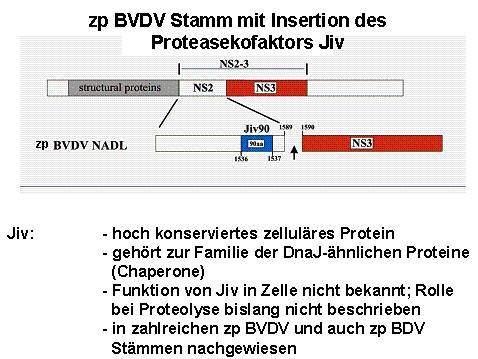
(1) Rearrangements oder Mutationen, welche die NS2 Autoprotease aktivieren. Hierbei kommt es zu erhöhter Produktion von NS3 und folglich erhöhter RNA Replikation. So enthält der Stamm NADL innerhalb des NS2 Gens ein Fragment des zellulären Jiv Gens Abb. 2). Wie unten beschrieben, handelt es sich bei Jiv um einen Kofaktor der NS2 Protease (11). Überexpression von Jiv und auch des Fragmentes führt zu erhöhter nicht regulierter NS2-3 Spaltung.
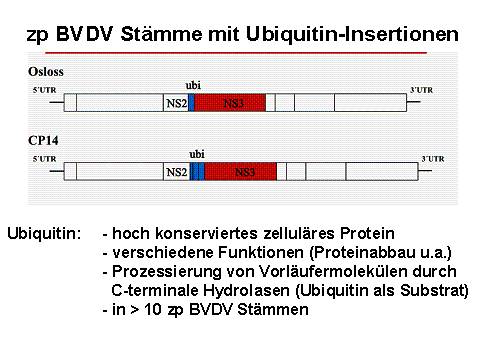
(2) Insertion von Ubiquitin oder Ubiquitin-ähnlichen kodierenden Sequenzen unmittelbar stromaufwärts von der NS3 kodierenden Region. Solche Insertionen führen zur Prozessierung des Polyproteins durch zelluläre Proteasen wie Ubiquitin C-terminale Hydrolase und somit ebenfalls zu erhöhter Bildung von NS3 (17) (Abb. 3).
Neben der Veränderung des nzp Virus im infizierten Tier kann MD durch Infektion eines persistent infizierten Tieres mit zp BVD-Virus, u.a. durch Impfung, ausgelöst werden (3). Nach Übertragung des zp Virus erfolgt der Ausbruch der Erkrankung entweder innerhalb von drei Wochen (Frühform oder „early onset“ MD) oder erst mehrere Monate später (Spätform oder „late onset“ MD) (6). Bei der Frühform ist das zp Virus dem persistierenden nzp Virus sehr ähnlich und löst die Erkrankung direkt aus. Die Spätform der MD ist hingegen auf eine Rekombination des zp Virus mit dem persistierenden nzp Virus zurückzuführen, wobei das nzp BVD-Virus vor allem den für Zytopathogenität verantwortlichen Genomabschnitt von zp Virus erhält. Somit entsteht eine zp Viruschimäre, die sich im persistent infizierten Tier aufgrund der erworbenen Immuntoleranz ungehindert ausbreiten kann.
Ein genetisches System zur Untersuchung der BVDV Replikation
Anhand authentischer cDNA Kopien („infektiöse cDNA“) des BVDV-Genoms konnte ein revers genetisches System für BVDV etabliert werden, welches die in vitro Synthese von BVDV Genomen erlaubt (16). Nach Einbringung dieser RNAs in bovine Zellen läuft der vollständige Replikationszyklus ab und es werden neue infektiöse Partikel gebildet. Mit diesem System können auch genetisch veränderte virale Genome hergestellt werden, um Rückschlüsse auf die Funktion einzelner viraler Proteine zu erhalten.
Arbeiten mit diesem System haben gezeigt, dass bei Pestiviren mit Ausnahme von Npro alle viralen Proteine notwendig sind um infektiöse Nachkommenviren zu erzeugen (24); neben den reifen Proteinen wird zusätzlich ungespaltenes NS2-3 benötigt (2).
Im Gegensatz dazu sind für die Replikation der viralen RNA die Proteine NS3, NS4A, NS4B, NS5A und NS5B ausreichend; Npro, p7, NS2, ungespaltenes NS2-3 sowie alle Strukturproteine werden hierfür nicht benötigt (4).
Virale RNA Replikation und Persistenz bei BVDV
Für die Persistenz von BVDV von herausragender Bedeutung, dass das Virus replizieren kann ohne den Tod der Wirtszelle zu induzieren. Die Menge der in der Zelle vorhandenen viralen RNA spielt dabei eine zentrale Rolle. Bereits 1998 wurde nachgewiesen, dass Zellen nach einer zp BVDV Infektion erheblich größere Mengen viraler RNA enthalten als nzp BVDV infizierte Zellen (15, 25). Ein Zusammenhang zwischen viraler RNA Menge und dem Tod der infizierten Zelle wird vermutet, ist aber bis dato nicht bewiesen worden. Mehrere Arbeiten haben aber gezeigt, dass die zp BVDV Infektion den programmierten Zelltod mittels Apoptose verursacht (1, 7-9, 13, 26). Ein möglicher Auslöser der Apoptose könnte doppelsträngige virale RNA sein, die als Replikationsintermediat gebildet wird. Darüber hinaus könnte auch die gesteigerte virale Proteinsynthese, welche mit der höheren Abundanz der zp BVDV RNA einhergeht, die Apoptose auslösen.
Diese Befunde machen deutlich, dass der intrazellulären Menge viraler RNA in BVDV infizierten Zellen eine zentrale Bedeutung für die virale Persistenz zukommt: Nur wenn es dem Virus gelingt die Menge viraler RNA unter einem kritischen Schwellenwert zu halten, unterbleibt die Apoptose der Wirtszelle und das Virus kann persistieren.
Regulation der RNA Replikation bei RNA Viren
Viren haben viele unterschiedliche Mechanismen zur Regulation der Genomreplikation ausgebildet:
Viele Viren modulieren die Genomreplikation mittels differentieller Transkription subgenomischer mRNAs, wodurch die Menge der verschiedenen an der Replikation beteiligten Proteine variiert werden kann. Dieser Mechanismus kommt bei den Pestiviren nicht zum tragen, da neben der genomischen RNA keine zusätzlichen subgenomischen mRNAs entstehen.
Bei animalen plus-Stang RNA Viren umfasst die Proteinexpression stets die Translation eines Polyproteins, welches unter Beteiligung viruskodierter Proteasen sukzessiv in die funktionellen Proteinfragmente zerlegt wird (10). Dabei üben häufig Prozessierungszwischenprodukte essentielle Funktionen aus, wie z.B. für das Poliovirus gezeigt wurde. In Analogie ist im BVDV System ungespaltenes NS2-3 essentiell für die Bildung infektiöser Viruspartikel (2). Für das Sindbisvirus, ein Alphavirus, wurde weiterhin nachgewiesen, dass sich im Verlauf der Infektion das Prozessierungsmuster des Polyproteins verändert: Während anfangs noch ungespaltene Vorläufermoleküle vorliegen, erfolgt später eine vollständige Prozessierung der Nichtstrukturproteine. Dadurch kommt es spät in der Infektion zu einem Umschalten auf die reine Synthese plus-strängiger genomischer RNAs, welche für die Erzeugung neuer infektiöser Partikel benötigt werden (14).
Zusammengefasst lässt sich feststellen, dass bei plus-Strang RNA Viren der Polyproteinprozessierung eine wesentliche Bedeutung für die Regulation der viralen Replikation zukommt.
Zeitliche Regulation der NS2-3 Prozessierung bei nzp BVDV
Zwischen zp und nzp BVDV Stämmen ist seit langem ein Unterschied im Prozessierungsmuster des Polyproteins bekannt, nämlich die Expression großer Mengen NS3 selektiv in zp BVDV infizierten Zellen (5, 19). Es galt lange als Dogma, dass nach einer nzp BVDV Infektion nur ungespaltenes NS2-3 und kein NS3 exprimiert wird. Daher wurde stets angenommen, dass in nzp BVDV infizierten Zellen das ungespaltene NS2-3 die essentiellen Funktionen von NS3 bei der RNA Replikation übernimmt. Kürzlich publizierte Arbeiten widerlegen jedoch diese Annahmen. Die diesbezüglichen Untersuchungen bezogen sich auf den zp BVDV Stamm CP7. Dieses Virus weist eine stammspezifische 9-Aminosäuren-Insertion zentral im NS2 auf, welche essentiell und ausreichend ist, um eine effiziente NS2-3 Spaltung zu induzieren und somit den zp Biotyp des Virus zu bestimmen (21). In Analogie zum humanpathogenen Hepatitis C Virus, für welches bereits die Existenz einer Cystein-Protease im NS2 beschrieben war, konnte gezeigt werden, dass auch die NS2-3 Spaltung des BVDV CP7 durch eine virale Protease im NS2 erfolgt (12). Die NS2 Autoprotease katalysiert die intramolekulare Spaltung des NS2-3 in NS2 und NS3. Die Inaktivierung der NS2 Protease im Kontext des Stamms CP7 mittels Mutagenese führte aber nicht zur Erzeugung eines nzp Virus, sondern zur vollständigen Inhibition der viralen RNA Replikation (12). Das Experiment zeigte, dass es sich bei der NS2 Protease um ein essentielles Enzym handelt und dass die Freisetzung von NS3 essentiell für die virale Replikation ist. Diese Experimente erlaubten auch die Schlussfolgerung, dass die Funktion von NS3 nicht durch ungespaltenes NS2-3 ersetzt werden kann.
Interessanter Weise führte die Inaktivierung der NS2 Protease auch im Kontext eines nzp BVDV Stamms zur Inhibition der viralen Replikation. Diese Ergebnisse legten nahe, dass auch in nzp BVDV infizierten Zellen eine NS2-3 Prozessierung/NS3 Expression erfolgt. Es war zu vermuten, dass entweder stets sehr wenig NS3 erzeugt wird, oder dass NS3 nur zu bestimmten Zeitpunkten nach Infektion generiert wird. Um eine dieser Möglichkeiten zu bestätigen, erfolgte zu verschiedenen Zeitpunkten nach Infektion von Gewebekulturzellen mit nzp BVDV eine metabolische Markierung mit 35S-Methionin und Cystein für einen Zeitraum von jeweils einer Stunde. Anschließend wurden die Zellen aufgeschlossen und vorhandenes NS2-3 und NS3 mittels Immunpräzipitation angereichert, in der SDS-PAGE aufgetrennt und per Autoradiographie dargestellt. Es zeigte sich, dass in nzp BVDV infizierten Zellen im Zeitraum zwischen 5 und 8 h nach Infektion NS3 vorhanden ist; zu späteren Zeitpunkten wird in den Zellen nur noch ungespaltenes NS2-3 nachgewiesen (12).
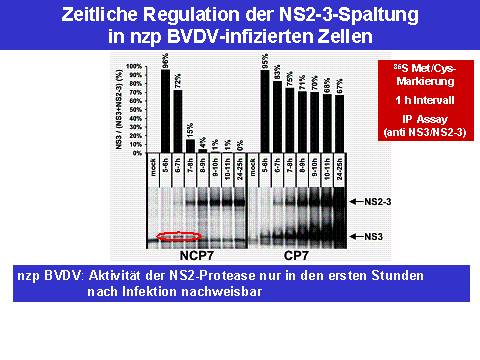
Wie oben ausgeführt stellt NS3 einen essentiellen Bestandteil der viralen Replikase dar, der funktionell nicht durch ungespaltenes NS2-3 ersetzt werden kann. Die Generierung von NS3 nur in den ersten 8 h nach Infektion mit nzp BVDV legte somit den Schluss nahe, dass es zu späteren Zeitpunkten zu einer Herabregulierung der nzp BVDV RNA Replikation kommen sollte. Um dies zu überprüfen wurden nzp oder zp BVDV infizierte Zellen mit 32P metabolisch markiert, die zelluläre RNA Synthese inhibiert und somit die neu synthetisierte virale RNA selektiv markiert. Die Analyse dieser RNAs ergab zu frühen Zeitpunkten (5-8 h) nach Infektion für zp und nzp BVDV vergleichbare RNA Replikationsaktivitäten; zu späten Zeitpunkten (24-26 h p.I.) brach hingegen die virale RNA Synthese selektiv in den nzp BVDV infizierten Zellen ein (12).
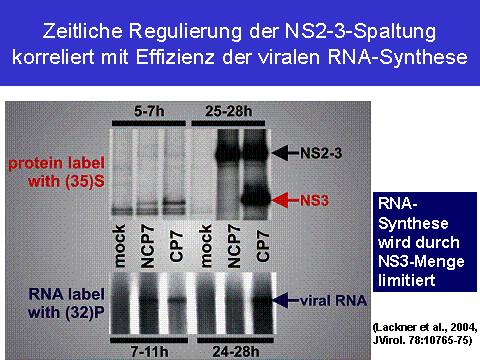
Dieses Experiment belegt, eine Korrelation zwischen der zeitlichen Regulierung der NS2-3-Spaltung und der der Effizienz der viralen Replikation in nzp BVDV infizierten Zellen.
Mechanismus der zeitlichen Regulation der NS2-3 Prozessierung bei nzp BVDV – die Rolle eines zellulären Chaperons
Die oben beschrieben Befunde belegen, dass in nzp BVDV infizierten Zellen bereits neun Stunden nach der Infektion keine NS2 Proteasaktivität mehr nachweisbar ist, obwohl die NS2-3 Synthese auf hohem Niveau fortgesetzt wird. Dieser außergewöhnliche Befund legte nahe, dass sich (i) in nzp BVDV infizierten Zellen entweder ein die Spaltung inhibierender Faktor im Lauf der Infektion anreichert oder (ii) ein für die Spaltung durch die NS2 Protease essentieller Faktor verbraucht wird.
Wie oben ausgeführt, zeigen verschiedene zp BVDV Stämme zeigen eine deregulierte, also über den ganzen Infektionszyklus anhaltende NS2-3-Spaltung. Für einen dieser Stämme, zp BVDV CP8, war gezeigt worden, dass ein im N-terminalen Bereich des Polyproteins insertiertes Fragment eines zelluläres J-Domänenproteins für die NS2-3-Spaltungsinduktion essentiell und ausreichend war (18). Weitere Arbeiten hatten gezeigt, dass das zelluläre J-Domänenprotein mit dem viralen NS2 Protein eine stabile Interaktion eingeht. Daher wurde das zelluläre Protein als „J-domain protein interacting with viral protein“ (Jiv) bezeichnet (20). Weiterhin führte die Koexpression von nzp BVDV NS2-3 und Jiv oder dessen 90 Aminosäuren langen Fragments Jiv90 im heterologen System zur Induktion der NS2-3-Spaltung (20).
Aufgrund dieser Daten stellte das zelluläre Protein Jiv einen attraktiven Kandidaten dar, der für die zeitliche Regulation der NS2-3 Prozessierung in nzp BVDV infizierten Zellen verantwortlich ist.
Jiv als essentieller Kofaktor der NS2 Protease
Eine Möglichkeit war, dass die Bindung von Jiv an NS2 zur Aktivierung der NS2 Protease führt. Um dies zu überprüfen, erfolgte eine Koexpression von Jiv mit nzp BVDV NS2-3; zusätzlich wurde Jiv mit eine proteolytisch inaktiven nzp BVDV NS2 Proteasemutante koexprimiert (11). Es zeigte sich, dass eine intakte nzp BVDV NS2 Protease eine essentielle Voraussetzung für die Jiv-induzierte NS2-3-Spaltung ist. Dieser Versuch belegt, dass es sich bei Jiv nicht um eine Protease handelt welche NS2-3 spaltet. Vielmehr handelt es sich bei Jiv um einen essentiellen Kofaktor der NS2 Protease von nzp BVDV.

Zusammen mit weiteren Analysen, welche eine direkte proteolytische Aktivität von Jiv ausschlossen, ergaben diese Untersuchungen, dass es sich bei Jiv um einen essentiellen Kofaktor der viralen NS2 Protease handelt (11).
Der Jiv-Spiegel limitiert die NS2-3-Spaltung und RNA Replikation in nzp BVDV infizierten Zellen
Unsere Untersuchungen hatten gezeigt, dass in Rindergewebekulturzellen nur sehr wenig Jiv-Protein exprimiert wird. Zusammen mit der Rolle von Jiv als essentieller Kofaktor der NS2 Protease von nzp BVDV führte dies zur Hypothese, dass der intrazelluläre Jiv-Spiegel ursächlich für die zeitliche Limitierung der NS2-3-Spaltung in nzp BVDV infizierten Zellen ist. Um dies zu überprüfen, wurden rekombinante Rinderzellen, welche eine regulierte Überexpression von Jiv erlauben, mit nzp BVDV infiziert. Die Überexpression von Jiv hatte folgende Auswirkungen: (i) auch zu späten Zeitpunkten nach Infektion erfolgte die Generierung von NS3; die zeitliche Herabregulierung der NS2-3 Spaltung wurde also außer Kraft gesetzt; (ii) die Menge der intrazellulären viralen RNA stieg durch die Anhebung des Jiv Spiegels ca. um den Faktor 10 an (iii) die Zellen zeigten einen zytopathischen Effekt; somit kommt es in Anwesenheit hoher Jiv-Mengen zu einem Biotypwechsel von nzp zu zp BVDV (11).

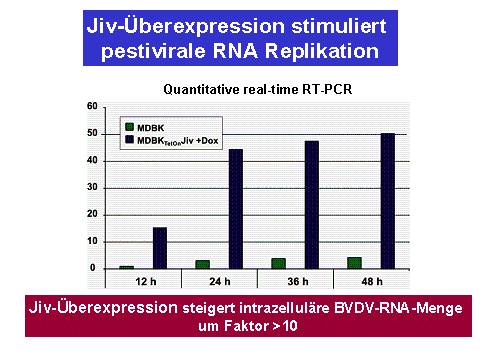
Der limitierende Effekt von Jiv ist essentiell für die virale Persistenz
Als Schlussfolgerung lässt sich festhalten, dass ein niedriger Jiv-Spiegel eine Voraussetzung für den nzp Biotyp von BVDV ist (11). Wird der darauf basierende Regulationsmechanismus für die virale Replikation aufgehoben, z.B. durch Anhebung des intrazellulären Jiv-Spiegels, ist BVDV nicht mehr in der Lage eine persistierende Infektion auszubilden. Im BVDV System ist somit ein Wirtsfaktor, der die virale Replikation limitiert, entscheidend für die Fähigkeit dieses Virus persistierende Infektionen zu etablieren. Zp BVDV Stämme haben aufgrund von Mutationen die Fähigkeit zur zeitlichen Regulation der NS3-Expression und damit der viralen RNA Replikation verloren. Einhergehend damit sind sie auch nicht mehr in der Lage persistierende Infektionen im Rind zu etablieren.
Zukünftige Arbeiten sollen zeigen, ob es sich beim bovinen Wirtsfaktor Jiv um ein Protein handelt, welches essentiell für die Replikation von nzp BVDV ist. Sollte dies der Fall sein, kann mit züchterischen oder genetischen Methoden versucht werden ein für BVDV unempfängliches Rind zu generieren.
Referenzen
- Adler, B., H. Adler, H. Pfister, T. W. Jungi, and E. Peterhans. 1997. Macrophages infected with cytopathic bovine viral diarrhea virus release a factor(s) capable of priming uninfected macrophages for activation-induced apoptosis. J Virol 71:3255-8.
- Agapov, E. V., C. L. Murray, I. Frolov, L. Qu, T. M. Myers, and C. M. Rice. 2004. Uncleaved NS2-3 Is Required for Production of Infectious Bovine Viral Diarrhea Virus. J Virol 78:2414-25.
- Becher, P., M. Orlich, and H.-J. Thiel. 2001. RNA recombination between persisting pestivirus and a vaccine strain: generation of cytopathogenic virus and induction of lethal disease. J Virol 75:6256-64.
- Behrens, S.-E., C. W. Grassmann, H.-J. Thiel, G. Meyers, and N. Tautz. 1998. Characterization of an autonomous subgenomic pestivirus RNA replicon. J Virol 72:2364-2372.
- Donis, R. O., and E. J. Dubovi. 1987. Differences in virus-induced polypeptides in cells infected by cytopathic and noncytopathic biotypes of bovine diarrhoea-mucosal disease virus. Virology 158:168-173.
- Fritzemeier, J., I. Greiser-Wilke, L. Haas, E. Pituco, V. Moennig, and B. Liess. 1995. Experimentally induced "late-onset" mucosal disease - characterization of the cytopathogenic viruses isolated. Veterinary Microbiology 46:285-294.
- Grummer, B., S. Bendfeldt, and I. Greiser-Wilke. 2002. Apoptosis inhibitors delay the cytopathic effect of bovine viral diarrhoea virus (BVDV). J Vet Med B Infect Dis Vet Public Health 49:298-303.
- Grummer, B., S. Bendfeldt, B. Wagner, and I. Greiser-Wilke. 2002. Induction of the intrinsic apoptotic pathway in cells infected with cytopathic bovine virus diarrhoea virus. Virus Res 90:143-53.
- Hoff, H. S., and R. O. Donis. 1997. Induction of apoptosis and cleavage of poly(ADP-ribose) polymerase by cytopathic bovine viral diarrhea virus infection. Virus Res 49:101-113.
- Kräusslich, H. G., and E. Wimmer. 1988. Viral proteinases. Annu Rev Biochem 57:701-54.
- Lackner, T., A. Müller, M. König, H.-J. Thiel, and N. Tautz. 2005. Persistence of bovine viral diarrhea virus is determined by a cellular cofactor of a viral autoprotease. J Virol 79:9746-55.
- Lackner, T., A. Muller, A. Pankraz, P. Becher, H. J. Thiel, A. E. Gorbalenya, and N. Tautz. 2004. Temporal modulation of an autoprotease is crucial for replication and pathogenicity of an RNA virus. J Virol 78:10765-75.
- Lambot, M., E. Hanon, C. Lecomte, C. Hamers, J. J. Letesson, and P. P. Pastoret. 1998. Bovine viral diarrhoea virus induces apoptosis in blood mononuclear cells by a mechanism largely dependent on monocytes. J Gen Virol 79:1745-9.
- Lemm, J. A., T. Rümenapf, E. G. Strauss, J. H. Strauss, and C. M. Rice. 1994. Polypeptide requirements for assembly of functional sindbis virus replication complexes: a model for the temporal regulation of minus- and plus-strand RNA synthesis. EMBO J 13:2925-2934.
- Mendez, E., N. Ruggli, M. S. Collett, and C. M. Rice. 1998. Infectious bovine viral diarrhea virus (strain NADL) RNA from stable cDNA clones: a cellular insert determines NS3 production and viral cytopathogenicity. J Virol 72:4737-45.
- Meyers, G., N. Tautz, P. Becher, H.-J. Thiel, and B. Kümmerer. 1996. Recovery of cytopathogenic and noncytopathogenic bovine viral diarrhea viruses from cDNA constructs. J Virol 70:8606-8613.
- Meyers, G., and H.-J. Thiel. 1996. Molecular characterization of pestiviruses. Advances in virus research 47:53-117.
- Müller, A., G. Rinck, H.-J. Thiel, and N. Tautz. 2003. Cell-derived sequences located in the structural genes of a cytopathogenic pestivirus. J Virol 77:10663-10669.
- Pocock, D. H., C. J. Howard, M. C. Clarke, and J. Brownlie. 1987. Variation in the intracellular polypeptide profiles from different isolates of bovine viral diarrhea virus. Arch Virol 94:43-53.
- Rinck, G., C. Birghan, T. Harada, G. Meyers, H.-J. Thiel, and N. Tautz. 2001. A cellular J-domain protein modulates polyprotein processing and cytopathogenicity of a pestivirus. J Virol 75:9470-82.
- Tautz, N., G. Meyers, R. Stark, E. J. Dubovi, and H.-J. Thiel. 1996. Cytopathogenicity of a pestivirus correlated with a 27 nucleotide insertion. J Virol 70:7851-7858.
- Thiel, H.-J., M. S. Collett, E. A. Gould, F. X. Heinz, M. Houghton, G. Meyers, R. H. Purcell, and C. M. Rice. 2005. Family Flaviviridae, p. 979-996. In C. M. Fauquet, M. A. Mayo, J. Maniloff, U. Desselberger, and L. A. Ball (ed.), Virus Taxonomy. VIIIth Report of the International Committee on Taxonomy of Viruses. Academic Press, San Diego, USA.
- Thiel, H.-J., P. G. W. Plagemann, and V. Moennig. 1996. Pestiviruses, p. 1059-1073. In B. N. Fields, D. M. Knipe, and P. M. Howley (ed.), Fields Virology, 3rd ed, vol. 1. Lippincott - Raven Publishers, Philadelphia, New York.
- Tratschin, J. D., C. Moser, N. Ruggli, and M. A. Hofmann. 1998. Classical swine fever virus leader proteinase Npro is not required for viral replication in cell culture. J Virol 72:7681-4.
- Vassilev, V. B., and R. O. Donis. 2000. Bovine viral diarrhea virus induced apoptosis correlates with increased intracellular viral RNA accumulation. Virus Res 69:95-107.
- Zhang, G., S. Aldridge, M. C. Clarke, and J. W. McCauley. 1996. Cell death induced by cytopathic bovine diarrhoea virus is mediated by apoptosis. J Gen Virol 77:1677-1681.

