Quervernetzungen zwischen Kollagenmolekülen bilden eine Gruppe von Verbindungen, die über eine komplexen Prozess gebildet werden, der durch die oxidative Desaminierung von Lysin- oder Hydroxylysinresten an den Telopeptiden des Kollagenmoleküls initiiert wird und zur Bildung von Aminoaldehyden(Lysald oder Hylald) führt. Durch eine Kondensation der Aldehyde mit bestimmten Aminosäuren in benachbarten Kollagenketten werden zunächst intermediäre Verbindungen gebildet, aus denen im Verlauf dann reife Endprodukte entstehen.
Je nach Art der Aminosäure im Telopeptid des Kollagenmoleküls wird ein Lysald- oder Hylald -Weg der Quervernetzungsbildung unterschieden.
Der Lysald-Weg ist typisch für weiches Gewebe wie Haut (intermediäredifunktionelle Quervernetzung: Hydroxylysinonorleucin (HLNL)*, reife trifunktionelle Quervernetzung: HistidinohydroxylysinonorleucinHHL).
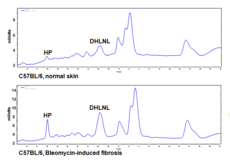
Der Hylald-Weg ist typisch für skelettales Gewebe, kann aber auch während der Wundheilung (Abb. 1) und bei Fibrosen (Abb. 2) in der Haut vermehrt nachgewiesen werden (intermediäre difunktionelle Quervernetzung: Dihydroxylysinonorleucin (DHLNL)*; reife trifunktionelle Quervernetzungen: Hydroxylysylpyridinolin (HP), Lysylpyridinolin (LP)). Während die difunktionellen, intermediären Verbindungen ein Marker für die Neusynthese des Kollagens sind, spielen die reifen Verbindungen eine besondere Rolle für die biomechanische Kompetenz eines Gewebes.
Eine weitere Gruppe von Quervernetzungen kommt im Elastin vor und entsteht ebenfalls durch Oxidation von Lysylresten durch die Lysyloxidase (Isodesmosin (IDES), Desmosin (DES)).
Die Gruppe analysiert das Quervernetzungsmuster des Kollagens und Elastins als Marker für Wundheilung und Fibrosen in verschieden Tiermodellen, menschlichen Erkrankungen und in der Zellkultur.
*Die Nomenklatur im Textbezieht sich auf die reduzierten Varianten der difunktionellen Verbindungen.